CRA
治験における
情報交換の主役
内勤CRA
治験立ち上げの
スペシャリスト
CTM
プロジェクトの
司令塔
CTC
プロジェクトの
スーパーアシスタント
CDS/DM
治験データ取り扱いの
スペシャリスト
PV
医薬品・医療機器の
安全使用に関する
情報のエキスパート
- CRA
- 内勤CRA
- CTM
- CTC
- CDS/DM
- PV
- Others
治験における情報伝達の主役CRA:
Clinical Reseacrch Associate
臨床開発モニター
CRAは、臨床試験(治験)が科学的・倫理的に医療機関で実施されているかどうかを確認します。医療用医薬品として各国の規制当局から製造販売承認を受けるためには、規制当局が定めた関連法規や治験の実施計画書に従って実施された治験データを集める必要があります。
CRAはその治験が、
- 規制当局が定めた関連法規に従って実施されているか
- 実施計画書に従って実施されているか
- データは正確に記録されているか
- 被験者の人権、安全、福祉が保護されているかの確認(モニタリング)する業務です。
また、CRAは治験における情報伝達の主役であり、治験に関する情報について治験依頼者である製薬会社と医療機関の間で橋渡しをする重要な役割を担っています。既に日本では、治験として実施されている臨床試験の7割以上が、世界で同時に実施するグローバル治験であり、CRAは日本国内のみの試験だけではなく、グローバル治験を担当する必要があります。

新日本科学PPDでは、効率的なモニタリングを実施する為に
下記のような形態のCRA職種があります。
Unblinded CRA:非盲検CRA
CRAが通常行う広範囲に渡る業務のうち、治験薬や薬剤部に関連する業務を専門的に行うCRAです。治験薬の盲検性を保つ為に、非盲検CRAを設け、治験薬の特定や管理・データのモニタリング等を行います。
SIA: Site Intelligence and Activation
治験を実施する施設の立ち上げ(治験を実際に実施できる状況にするまで)を専門に行う職種です。施設の立ち上げ期間短縮が重要な最近の治験において非常に重要な職種となります。
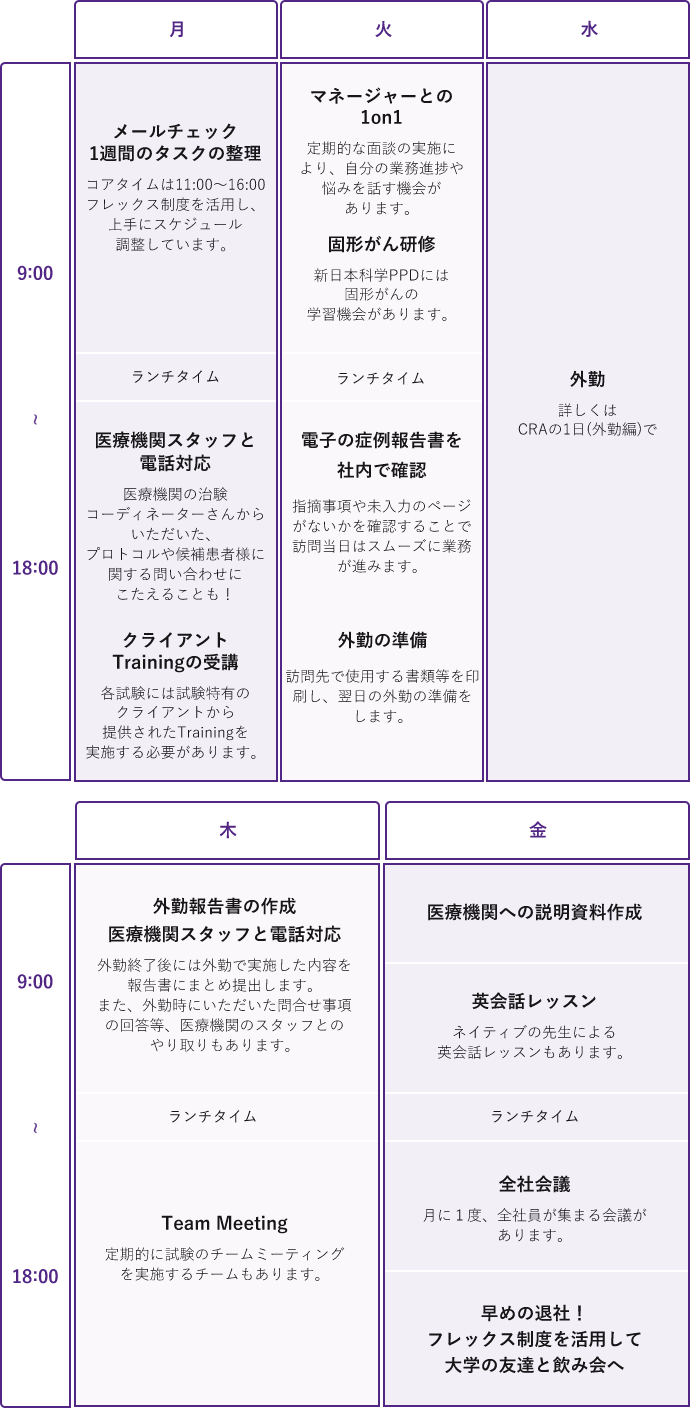
CRAの1週間

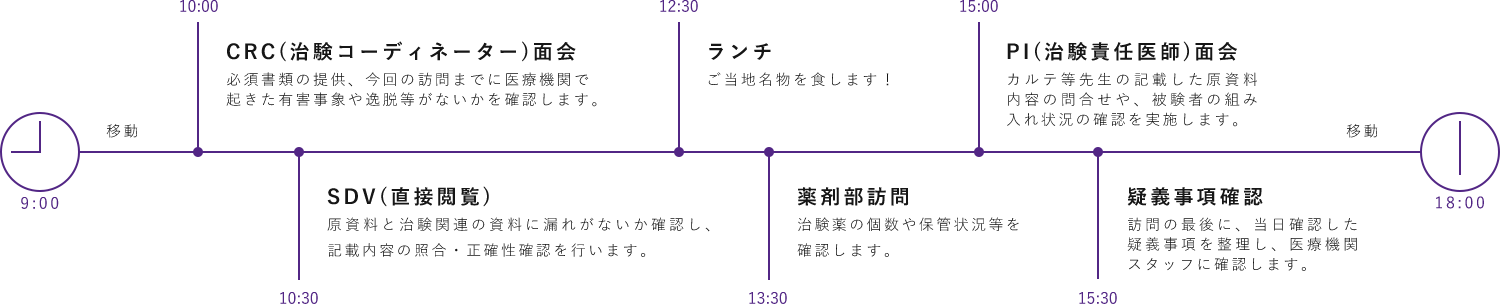
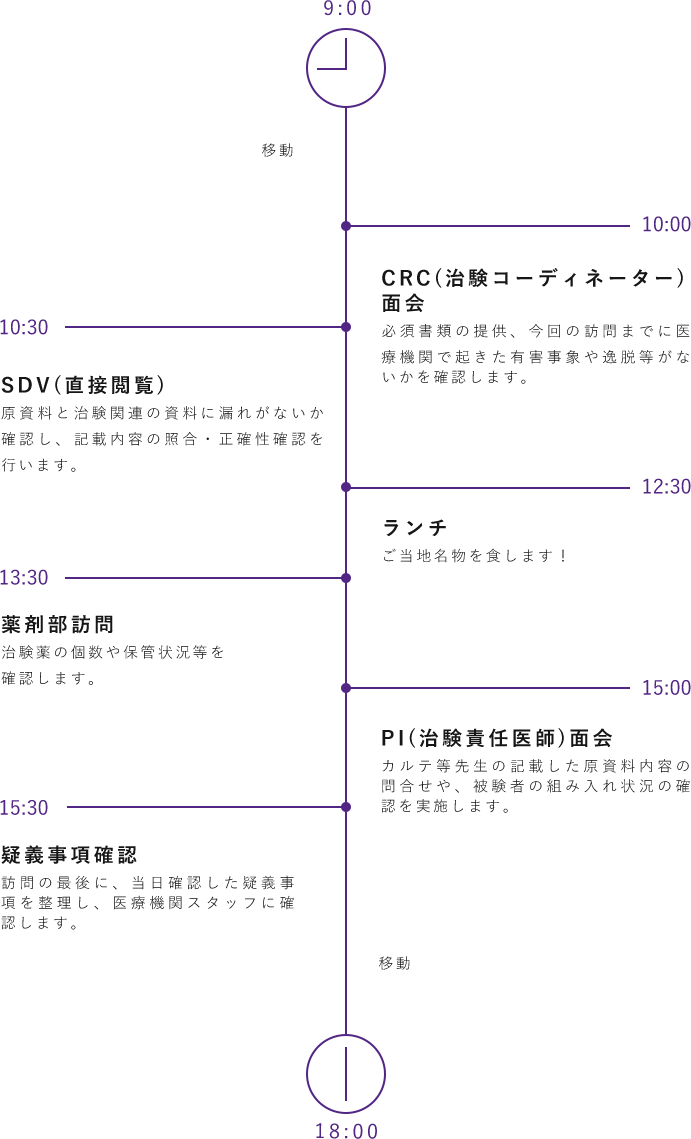
CRAの1日(外勤編)
治験立ち上げのスペシャリスト内勤CRA:
Clinical Reseacrch Associate
新しい薬をより早く患者さんに届けるために、私たちは内勤CRAとCRAという異なる業務範囲のスペシャリストとして業務を分担しています。
内勤CRAは立ち上げのフェーズにおいてはIRB申請や契約書の作成といった手続き関連の業務を担っています。また、モニタリングフェーズにおいては、各種システムへの入力状況を確認し、早期にCTM/CRAへフィードバックすることで、質の高いモニタリングの一部を担っています。
内勤CRAは自身の知識や経験を活用しながら、リモートで治験実施施設やSMOとやり取りを行います。治験依頼者、治験実施施設、SMOのそれぞれの要望を汲み取りながら調整を進める必要があるため、CRAとしての経験はもちろんのこと、プロジェクトの戦略に則った申請スケジュールの計画性及び関連部門との円滑なコミュニケーション能力が求められます。

内勤CRAの主な業務内容
- 日本で試験するにあたり必要となる資料の作成
- 施設との協議を含めたIRB初回申請資料の作成
- 予算、契約内容の確認および契約書/覚書の作成
- 治験薬搬入までに必要とされる文書の作成/提出/入手
- 各種システムに入力された進捗状況の確認
- 被験者登録後のデータレビュー
プロジェクトの司令塔CTM:
Clinical Team Manager
CTMは、臨床試験(治験)の実務をつかさどる司令塔です。
CTMにとって、社内だけでなく、治験を委託するクライアント(製薬会社)と一丸となって、一日も早くお薬を患者様のもとに届けることが最大の目標となります。
そのためにCTMは、適切に治験を実施できるよう直接CRAを指揮し、また、プロジェクトが円滑に進むように、クライアントとの交渉やプロジェクトのスケジュール管理、予算管理等を行います。
また、CTMは責任を持ってCRAを育成し、CRAの成長度合いを勘案しながら、実務を通してCRAのキャリア開発を促進させる役割を担います。

CTMの1週間
- 担当試験における、医療機関側のあらゆる運営・品質面の管理
- プロジェクトチームのパフォーマンス管理と、個々のキャリアビジョンを理解した教育・育成業務
- クライアントとの交渉と、ニーズを満たすためのチーム作り
- メンバーが抱える課題や問題、メンバー間でのコンフリクト等の解消のための支援
プロジェクトのスーパーアシスタントCTC:
Clinical Trial Coordinator
社内にて、プロジェクトチームで発生したドキュメントの確認/管理や安全性情報の施設への発送など、CRA、RSM、CTMではまかなえない業務を担うことで、治験の立ち上げから世の中に薬がでるまでの全ての工程に携わるスーパーアシスタントです。
プロジェクトの運営を円滑に進めるために、プロジェクトチームのメンバーと日頃からコミュニケーションを綿密にとり、タイムリーなサポートを提供しています。

CTCの主な業務内容
- 規制当局に提出する文書など治験に関わるドキュメントの確認および管理
- 安全性情報の医療機関/責任医師への発送
- 印刷/翻訳等の各種ベンダー対応
- 医療機関からの請求書対応
- 監査時におけるファイルの準備やアシスト
治験データ取り扱いのスペシャリストCDS:
Clinical Data Science
DM・統計解析・メディカルライティング部門
高い専門性と処理能力をもつスタッフがGCPならびに関連法規に則り、データの信頼性を確保し、治験から製造販売後調査までの業務を正確かつ迅速に提供します。
新薬候補物質の安全性、有効性を科学的に証明する重要なデータの取りまとめを行っています。

DM(Data Management)
「医薬品の臨床試験」を実施して得られる治験薬の有効性・安全性等のデータ(治験データ)を効率的に集める方法(EDCシステムやデータベースの構築など)を考え、得られたデータ間で不整合がないかチェックを行い、統計解析の基盤となる情報の整理をする重要な役割を担っています。
Biostatistics(統計解析)
計画書に基づいて、DMが整理したデータを解析する職種です。その薬の有効性(効果)や安全性(有害事象・副作用)について科学的手法による解析を行い、最終的には申請する際の重要なデータを作成します。また、得られたデータに対して科学的な根拠を示すために統計的な手法も提案します。クライアントの要望によっては薬物動態の解析も行います。
Medical Writing(医薬関連文書作成)
医薬品に関わる各種文書(臨床試験実施に必要な文書及び結果報告書,承認申請のための文書,論文等)の作成をする職種です。各種規制,ガイドラインを遵守し,高度な医学的知識を駆使して高品質の文書を作成します。
CDSの主な業務
- 臨床開発CRAが収集した治験データ等の疑義事項の解決
- 収集した治験データを解析可能な形式へ変換
- 整えられたデータを元に医学的統計解析
- 新薬候補物質の安全性、有効性を科学的に証明する重要なデータの取りまとめ
医薬品・医療機器の安全使用に関する情報のエキスパートPV:
Pharmacovigilance
医薬品や医療機器の使用により、患者さんに健康被害(有害事象)が現れることがあります。薬を開発する段階でも同様に有害事象が発生することがあり、それらの情報を収集し、報告の要否を評価して、法に規定されている期限内に厚生労働省に報告する業務を行っています。
また、PVで評価された最新の安全性情報は、治験を実施している医療機関宛に提供され、治験に参加されている被験者の安全性を確保するために活用されています。

PVの主な業務内容
- 治験薬、市販薬、医療機器等の安全性情報管理業務
・安全性情報の収集、評価
・安全性データベースへの入力、当局報告書作成
・当局への安全性情報の報告
・治験実施医療機関への安全性情報の提供
新日本科学PPDのその他職種について簡単にご紹介します。Others
RA: Regulatory Affairs(薬事)
治験届、規制当局(PMDA等)との相談業務や、薬事情報の収集・管理などを行う
MM:Medical Monitor
グローバル/国内治験―メディカルモニタリング業務や、ICCC (治験国内管理人) 安全性情報のメディカルレビューを行う。また、社内臨床チームに試験領域のトレーニングやビジネス・ディベロップメントをサポート
QC:Quality Control(品質管理/治験手順)
GCPのエキスパートとして治験に関連するDocumentが正確かつタイムリーに入手、提供されているか等を確認し、規制当局への申請書類の品質維持・向上に貢献する
QM:Quality Management(社内における品質管理体制の維持)
手順書の管理、文書保管、問題発生時の原因究明と再発予防、トレーニング等社内の品質管理体制を維持するための活動を実施・サポートする
Induction
入社から各部門にされるまでを全面的にサポートする
COC:Clinical Operation Consultant
治験実施における様々なシステム使用に関するエキスパート
DPO:Digital&ProcessOptimization
Decentralized Clinical Trials(DCT)の推進および業務プロセス改善、生産性向上活動、AI活用の推進やサポートを行う。
臨床営業
自社のサービスの魅力をより多くの顧客に伝え、自社と顧客の架け橋となる
GCP監査
治験が治験実施計画書、SOP、GCPを遵守して実施されているかを、通常のモニタリングまたは治験品質管理業務とは独立・分離して評価する










